통합효소 억제제의 발견과 개발

통합효소 억제제의 발견과 개발은 인간 면역결핍 바이러스(human immunodeficiency virus, HIV) 감염의 치료에서 바이러스 복제의 과정에 개입하는 새로운 치료법을 가능하게 하였다. 최초의 HIV 감염 사례는 1980년대 초 알려졌으며 그 이후 많은 약물이 치료를 위해 개발되었으나 바이러스 자체의 돌연변이에 의한 약물 내성의 형성으로 새로운 약물 개발이 점차 더 어려워 지게 되었다.
HIV는 레트로바이러스의 한 종류로 통합효소를 통해 인간 유전체에 자신의 역전사 DNA를 투입한다. 통합효소 억제제는 이러한 통합효소의 발현을 억제하여 바이러스 복제를 방해하는 약물로 2007년 랄테그라빌이 승인되었고 이후 계속하여 신약들이 개발 되어 시험적으로 사용되고 있다.
개요[편집]
HIV의 복제 과정[편집]

인간의 몸에는 세균, 바이러스, 그 외 다른 병원체의 감염을 스스로 처치하는 면역계가 있다. 면역결핍질환은 어떠한 이유로든 이러한 면역계가 제 기능을 하지 않는 질환으로 후천면역결핍증후군(Acquired Immune Deficiency Syndrome, AIDS)은 대표적인 면역결핍질환 가운데 하나이다. AIDS의 주요 원인은 HIV 감염이다.[1]
HIV에는 유전적으로 매우 가까운 두 종류의 바이러스가 알려져 있다. 보다 독성이 강한 HIV-1 은 전세계에 확산되어 AIDS에 의한 사망의 주요 원인으로 작용하고 있으며 이에 반에 독성이 비교적 약한 HIV-2는 인도와 서아프리카에서 주로 감염된다. HIV에 감염된 사람들 가운데 일부가 ADIS를 앓게 되며, 면역계 이상으로 기회감염에 의한 병원체 침입을 막지 못하거나 암의 발현을 억제하지 못하여 사망에 이르게 된다.
레트로바이러스는 숙주 밖에서 RNA로 이루어진 유전체를 지니고 있다가, 숙주에게 침투한 뒤 역전사를 통해 RNA를 DNA로 변환한 뒤, 통합효소를 통한 생합성 과정을 거쳐 자신의 DNA를 숙주의 DNA에 묶는다. 이렇게 숙주의 유전체에 통합된 레트로바이러스의 유전체는 숙주의 정상적인 세포 활동에 기생하여 유전자 발현과정에서 자신의 유전체를 복제하고 새롭게 바이러스 외피를 생산하게 한 후 숙주의 세포막을 파괴하면서 탈출한다. 이렇게 복제된 바이러스는 다시 또 다른 세포에 침투하여 복제를 반복한다.[2]
HIV의 복제 역시 위와 같은 절차를 따르며 특히 HIV-1의 복제는 그 과정을 잘 예측할 수 있어, 개발되는 항AIDS 약의 목표로 삼는다.
억제제의 종류[편집]
HIV의 복제 과정이 역전사, 통합효소를 통한 DNA 삽입, 단백질 분해를 통한 피막의 형성과 복제 완성이기 때문에, 그에 대한 대응 치료 약물 역시 역전사효소 억제제, 통합효소 억제제, 단백질분해효소 억제제로 구분할 수 있다.[3] 여기서는 이 가운데 통합효소 억제제의 발견과 개발 과정을 다룬다.
통합효소가 숙주의 DNA에서 역전사된 바이러스 DNA와 묶을 알맞은 상대를 찾지 못하게 하는 것이 통합효소 억제제의 역할이다.[4] 통합효를 억제할 수 있는 많은 물질이 발견되었으나 이 가운데 임상 실험까지 진행된 것은 몇 되지 않는다. 2007년 10월 랄테그라빌이 제품명 이센트레스로 FDA의 승인을 얻었다. 이센트레스는 두 달 뒤인 2007년 12월 유럽의약품기구의 승인도 받았다.[5][6] 랄테그라빌은 최소 세 종류의 항레트로바이러스 약물에 내성을 보이는 성인 HIV-1 감염인을 대상으로 시판되었다.
통합효소 억제제의 개요[편집]
일반적으로 통합효소 억제제에는 두 가지 종류가 있다. 하나는 통합효소 전사 억제제(Integrase Strand Transfer inhibitors, INSTI)로 사전통합 복합체와 숙주 DNA의 결합을 막는다. 다른 하나는 통합효소 결합 억제제(Integrase Binding Inhibitors, INBI)로 통합효소와 바이러스 DNA의 결합을 막는다. 최초로 개발된 통합효소 억제제인 랄테그라빌은 INSTI에 속하고 HIV-1과 HIV-2 모두에 효능이 있다. 라테그라빌이 널리 사용된 계기는 다른 억제제보다 부작용이 적었기 때문이다. 이후 통합효소 억제제로 엘비테그라빌, 돌루테그라빌, 빅테그라빌 등이 개발되었다.[5][7][8][9]
현재는 2세대 억제제로 분류되는 빅테그라비르와 돌루테그라비르가 통합효소 억제제의 대중을 이루고 있다.[10]
바이러스 자체의 돌연변이 때문에 통합효소 억제제도 점차 내성을 지닌 바이러스가 생겨나게 된다. 이 때문에 내성이 없는 새로운 억제제 개발이 계속되고 있다. 2019년 길리어드는 새로운 통합효소 억제제 빅테그라비르를 출시하였다.[11]
HIV-1 통합효소[편집]
HIV-1의 복제 과정에서 통합효소는 핵심적인 역할을 한다.[12] 통합효소는 역전사된 바이러스 DNA를 숙주의 DNA에 침투시켜 묶는다. 이 과정이 억제되면 바이러스는 더 이상 복제되지 않는다.[13] 바이러스의 통합효소가 숙주 세포에서 적합한 대상을 찾을 수 없게 되면 숙주 세포의 정상적인 유전자 발현을 간섭할 수 없게 되어 치료유효성이 높아지게 된다.[14]
구조[편집]
통합효소는 작용 방식이나 구조 면에서 모두 폴리뉴클레오타이드 전이효소 10에 속하며, 32 KDa 크기의 단백질로 288개의 아미노산으로 이루어져 있다.[12] 레트로바이러스의 유전체에는 단백질 분해효소, 역전사효소, 그리고 통합효소 등의 유전 정보가 POL 유전자에 담겨있는데 통합효소는 이 유전자의 제3 단말에 위치하고 있다.[14]

통합효소는 세 구획에서 구조적으로 독립적이며 각각 다음과 같이 기능한다.[12]
- . N-단말 도메인은 1번부터 50번까지 아미노산을 지정하고 His12, His16 두 개의 히스티딘 잔류물과 Cys40, Cys43 두 개의 시스테인 잔류물을 포함한다. 이것들은 모두 아연 집게에 의해 형태가 유지된다.[12][15] 이 네 잔류물 가운데 어느 하나라도 변이를 일으키면 통합효소의 활동을 줄일 수 있다.[14] 네 잔류물의 HHCC 아연 집게 구조 모티프는 통합효소 단량체 당 한 개의 아연 원자가 킬레이트 방식으로 결합되어 있다. N-단말 도메인은 핵심 역할을 수행하기 위해 소중합체가 되어야 하고[15][16] 이 중합 과정에서 단백질 접힘을 안정화 하기 위해 아연이 필요하다.[15]
- . 촉매 코어 도메인은 51번에서 212번 아미노산을 지정하며 통합효소의 활동 부위를 포함하지만, 앞의 N-단말 도메인과 뒤의 C-단말 도메인 없이는 효소 촉매작용을 일으킬 수 없다.[14] 촉매 코어 도메인은 3개의 음전하를 띄는 아미노산 D64, D116, 그리고 E152를 만든다.[12] 이 아미노산들은 2가 양이온인 마그네슘 이온과 망간 이온의 도움을 받아 DDE 모티프를 형성한다. 이 두 금속 이온은 통합효소의 촉매로서 작용한다.[15][16] 촉매 코어 도메인은 5개의 베타 시트와 6개의 알파 헬릭스가 혼합된 형태로 유연한 고리를 이루고 있다.[15] 이 유연성이 바이러스 DNA의 발현 과정에서 필요한 방향의 3´전환이 이루어지도록 한다.[12] 이러한 과정을 통해 형성된 DDE 모티프 구조가 깨지면 통합효소의 활동은 극적으로 둔화된다.[15]
- . C-단말 도메인은 213번에서 288번의 아미노산을 지정하는 불특정 DNA로 N-단말 도메인과 촉매 코어 도메인 사이의 상호 작용을 보조한다. 통합효소의 3´전환에 관여하고 역전사를 활성화 시킨다.[14][15]
기능[편집]
HIV-1 통합효소는 숙주 DNA의 3´ 단말에서 공급되는 내부핵산과 바이러스 DNA의 3´ 단말을 통합하기 위해 두 종류의 촉매 작용을 포함한 여러 단계의 과정을 거친다.[7] 이 과정을 통해 통합효소는 HIV-1 유전체에서 역전사된 DNA 가닥을 숙주의 DNA에 이어 붙여 바이러스가 복제될 수 있도록 한다.[12] 통합효소는 숙주 DNA의 목적 지점에서 디옥시리보스의 3´ 수산화기를 제거하여 DNA사슬을 끊고 바이러스 DNA의 3´ 단말로 대체한 후 다시 DNA를 이어 붙인다.[17] 이러한 결합은 숙주 DNA와 바이러스 DNA의 전자 공유 결합을 통해 이루어지며, 삽입되는 바이러스 DNA의 양 끝은 각각 5쌍의 염기가 숙주 DNA의 상보적 염기쌍과 결합하게 된다. 이 과정이 완료 되면 숙주의 세포가 감염된다.[12] DNA 사슬은 디옥시리보스 사이에서 3´- 5' 연결을 하는 방향성을 갖기 때문에 숙주 DNA와 바이러스 DNA의 결합 역시 이에 따라 짝이 맞지 않는 디뉴틀리오타이드를 제거하면서 마무리 된다.[12][17] 2가의 마그네슘 이온이나 망간 이온은 이러한 역전사 DNA의 삽입에 촉매로 작용하면서 통합효소의 작용이 보다 쉽게 일어날 수 있도록 한다. 사람의 몸 속에는 망간에 비해 마그네슘이 풍부하기 때문에 일반적으로 인체에서 통합효소의 촉매로 사용되는 것은 마그네슘이다.[7]
약물 작용 메커니즘[편집]
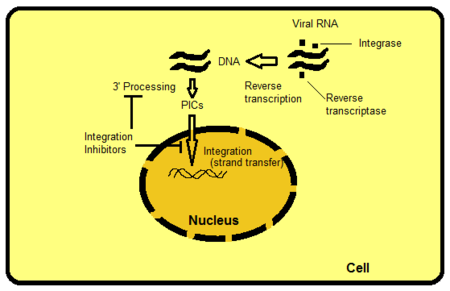
통합효소의 활동을 억제하는 방법에는 몇 가지가 있지만, 가장 직접적인 방식은 통합효소의 전사를 억제하는 것이다. HIV의 통합효소 역시 단백질로 바이러스 유전체의 전사 과정에 생성되기 때문에 이를 차단하면 바이러스 복제를 막을 수 있다. 다른 방식으로는 예를 들면 통합효소 활동 부위의 단백질 도메인을 목표로 하는 것이 있다. 이 단백질 도메인은 통합효소를 통해 숙주 DNA와 바이러스 DNA 모두와 상호 작용하여 사전통합 복합체를 구성한다. 이렇게 구성된 복합체를 분리시키거나 제거하면 효소가 작용할 대상이 없어져 바이러스 복제의 고리를 끊게 된다.[9]
통합효소 전사 억제제[편집]
HIV-1 통합효소의 단백질 구조와 촉매 결합은 이미 잘 연구되어 있다. 통합효소 전사 억제제는 통합 과정에서 촉매로 사용되는 마그네슘 이온과 망간 이온의 결합을 방해하여 효소의 전사 기능을 무력화 시킨다.[7]
랄테그라빌과 엘비테그라빌은 통합효소에 대항하여 같은 메커니즘으로 작용하는데, 통합효소 활동 부위의 마그네슘 이온에 결합한다.[9] 이 약품들과 경쟁하는 다른 억제제들은 바이러스 DNA에 직접 결합하여 숙주의 3‘ 단말과 결합을 억제한다.[18] 어느 쪽이건 목표로 삼는 DNA의 활동 부위를 막아 억제하기 때문에 "전사 억제제"에 속한다.[9]
LEDGF/p75- 통합 상호 작용 억제[편집]
수정체 상피 유래 성장 팩터(Lens epithelial derived growth factor, LEDGF/p75)로 불리는 PSIP1는 숙주의 단백질로 HIV의 통합효소에 결합하여 바이러스 복제의 중요한 과정에 관여한다. 정확한 메커니즘은 밝혀지지 않았지만 통합효소가 바이러스 DNA를 숙주 DNA에 삽입할 위치를 안내한다는 연구 결과가 있다. 따라서 이 팩터를 억제하면 바이러스의 복제 또한 억제 된다. 여기에 착안한 역제제가 이미 개발되어 있다.[9]
통합효소 결합 억제제[편집]
통합효소 억제제의 또 다른 종류로 통합효소 결합 억제제가 있다. 예를 들어 V-165는 HIV의 역전사된 DNA에는 작용하지 않으며 통합효소의 결합작용만 방해하여 바이러스 복제를 억제한다. 스티릴퀴노닌과 같은 물질은 DNA 말단의 긴 반복 구간에 작용하여 통합효소의 숙주 DNA 결합을 억제한다.[19]
약제 디자인[편집]
결합[편집]
통합효소 전사 억제제는 통합효소가 촉매인 마그네슘 2가 양이온의 집게를 이용하여 결합하는 DNA 말단에서 통합효소와 강력하게 결합하여 DDE 모티프를 형성한다.[12] DDE 모티프는 통합효소의 세 부분 가운데 하나인 촉매 코어 도메인에 위치하여 효소의 실제 활동 부위를 형성하기 때문에 이를 억제하면 효소를 무력화 시킬 수 있다. 통합효소 억제제가 실제로 하는 일은 DDE 모티브에 접근하는 바이러스 DNA의 3' 단말과 결합하는 것이다. 원래 사전통합 복합체를 통해 숙주 DNA에 결합하여야 할 바이러스의 3' 단말은 억제제와 결합되어 숙주 DNA로 삽입될 수 없다. 이러한 HIV DNA 삽입 차단으로 복제 메커니즘의 순환을 끊는다.[15][12]
통합효소 전사 억제제 개발에서 중요한 것은 억제제가 결합하게 될 DNA의 특정 위치를 잘 선정하여 독성을 낮추는 것이다.[15] 통합효소 전사 억제제는 바이러스의 DNA 뿐만 아니라 통합효소와도 결합하지만 그 메커니즘은 상세히 밝혀져 있지 않다.[19]
구조 작용 관계[편집]

통합효소 억제제의 구조 작용 관계에는 통합효소에서 촉매로 작용하는 2가 금속 이온을 포획할 구조가 필요하다. 엘비테그라빌과 랄테그라빌은 이를 위해 하나의 벤질기에 두 개의 소수성 포획 구조를 달았다.[20] 사실 최초의 통합효소 개발 이후 모든 억제제에는 작용 부분의 구조 유지를 위해 벤질기가 적용되었다. 벨질기가 제거되면 억제 기능 역시 중단된다.[18]
벤질기 구조에 달린 카테콜 구조의 변형 염화 구조물이 실제로 통합효소의 촉매 이온과 반응하는 부위이다.[9]
내성[편집]
통합효소 억제제에 내성을 지닌 HIV 변종 60여개가 발견되어 있다. 약물 내성이 발생하면 약효는 떨어지게 된다[12] 내성 발현의 가장 큰 이유는 다른 여러 항레트로바이러스 치료 요법 때문이다. 각종 약물에 자주 노출된 바이러스는 진화의 선택 과정을 통해 내성이 발현되기 쉽다. 게다가 통합효소 활동 부위에는 변이가 자주 일어나는 부위가 있어 이러한 내성 발현이 가속화된다.[16] 통합효소의 아미노산 서열 140–149번은 촉매 코어 도메인 부위에 있으면서 내성 발현에 깊이 관여한다.[12] 단백질 도메인의 크기가 크지 않기 때문에 같은 자리에서 독립적으로 동일한 돌연변이가 일어날 수도 있지만, 대개는 특정 약물의 작용에 반응하여 돌연변이가 일어나게 된다.[13] 돌연변이도 약물 내성이 큰 경우와 그렇지 않은 경우가 있다. 예를 들어 가장 큰 내성을 지니게 되는 돌연변이는 적은 것에 비해 100배나 약물 내성이 강하다.[12]
억제제의 개발 입장에서 보면 이러한 바이러스의 내성 때문에 계속하여 새로운 억제제의 개발이 필요하게 된다.[8] 최초에 개발된 통합효소 억제제인 랄테그라비르는 이미 바이러스의 내성으로 효용이 크게 제한적인 상황으로 여러 제약 회사들은 내성을 피할 신약 개발을 꾸준히 진행하고 있다.[8]
같이 보기[편집]
각주[편집]
- ↑ Johnson, Dee Unglaub Silverthorn ; with William C. Ober, illustration coordinator ; Claire W. Garrison, illustrator ; Andrew C. Silverthorn, clinical consultant ; with contributions by Bruce R. (2007). 《Human physiology : an integrated approach》 4판. San Francisco: Pearson/Benjamin Cummings. ISBN 978-0-8053-6849-9.
- ↑ Murphy, Kenneth; Travers, Paul; Walport, Mark (2008). 《Janeway's immunobiology》 7판. New York: Garland Science. ISBN 978-0-8153-4123-9.
- ↑ 에이즈약 통합효소억제제도 경쟁구도 돌입, Medical Observer, 2015sus 3월 27일
- ↑ Pommier, Y; Marchand, C; Neamati, N (Sep 2000). “Retroviral integrase inhibitors year 2000: update and perspectives”. 《Antiviral Research》 47 (3): 139–48. doi:10.1016/S0166-3542(00)00112-1. PMID 10974366.
- ↑ 가 나 Dąbrowska, Magdalena Monika; Wiercińska-Drapało, Alicja (2007년 1월 1일). “Integrase inhibitors as a new class of ARV treatment”. 《HIV & AIDS Review》 6 (4): 10–14. doi:10.1016/S1730-1270(10)60053-7.
- ↑ “FDA approval of Isentress (raltegravir)”. U.S. Food and Drug Administration (FDA). 2011년 9월 25일에 확인함.
- ↑ 가 나 다 라 Fan, X; Zhang, FH; Al-Safi, RI; Zeng, LF; Shabaik, Y; Debnath, B; Sanchez, TW; Odde, S; Neamati, N; Long, YQ (2011년 8월 15일). “Design of HIV-1 integrase inhibitors targeting the catalytic domain as well as its interaction with LEDGF/p75: a scaffold hopping approach using salicylate and catechol groups”. 《Bioorganic & Medicinal Chemistry》 19 (16): 4935–52. doi:10.1016/j.bmc.2011.06.058. PMC 3163123. PMID 21778063.
- ↑ 가 나 다 Lenz, JC; Rockstroh, JK (Apr 2011). “S/GSK1349572, a new integrase inhibitor for the treatment of HIV: promises and challenges”. 《Expert Opinion on Investigational Drugs》 20 (4): 537–48. doi:10.1517/13543784.2011.562189. PMID 21381981.
- ↑ 가 나 다 라 마 바 Pendri, A; Meanwell, NA; Peese, KM; Walker, MA (Aug 2011). “New first and second generation inhibitors of human immunodeficiency virus-1 integrase”. 《Expert Opinion on Therapeutic Patents》 21 (8): 1173–89. doi:10.1517/13543776.2011.586631. PMID 21599420.
- ↑ "HIV 치료, 3제요법도 약물독성 적어 제제 줄일 필요성 못 느껴", 청년의사, 2019년 4월 12일
- ↑ 진통제보다 작은 HIV치료제 '빅타비', 프레디 머큐리가 먹었다면, Parmnews, 2021년 5월 26일
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 Mouscadet, JF; Delelis, O; Marcelin, AG; Tchertanov, L (Aug–Oct 2010). “Resistance to HIV-1 integrase inhibitors: A structural perspective”. 《Drug Resistance Updates : Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy》 13 (4–5): 139–50. doi:10.1016/j.drup.2010.05.001. PMID 20570551.
- ↑ 가 나 Cocohoba, J; Dong, BJ (Oct 2008). “Raltegravir: the first HIV integrase inhibitor”. 《Clinical Therapeutics》 30 (10): 1747–65. doi:10.1016/j.clinthera.2008.10.012. PMID 19014832.
- ↑ 가 나 다 라 마 Pommier, Yves; Johnson, Allison A.; Marchand, Christophe (2005년 2월 24일). “Integrase inhibitors to treat HIV/Aids”. 《Nature Reviews Drug Discovery》 4 (3): 236–248. doi:10.1038/nrd1660. PMID 15729361.
- ↑ 가 나 다 라 마 바 사 아 자 McColl, DJ; Chen, X (Jan 2010). “Strand transfer inhibitors of HIV-1 integrase: bringing IN a new era of antiretroviral therapy”. 《Antiviral Research》 85 (1): 101–18. doi:10.1016/j.antiviral.2009.11.004. PMID 19925830.
- ↑ 가 나 다 Blanco, JL; Varghese, V; Rhee, SY; Gatell, JM; Shafer, RW (2011년 5월 1일). “HIV-1 integrase inhibitor resistance and its clinical implications”. 《The Journal of Infectious Diseases》 203 (9): 1204–14. doi:10.1093/infdis/jir025. PMC 3069732. PMID 21459813.
- ↑ 가 나 De Luca, Laura; De Grazia, Sara; Ferro, Stefania; Gitto, Rosaria; Christ, Frauke; Debyser, Zeger; Chimirri, Alba (Feb 2011). “HIV-1 integrase strand-transfer inhibitors: design, synthesis and molecular modeling investigation”. 《European Journal of Medicinal Chemistry》 46 (2): 756–764. doi:10.1016/j.ejmech.2010.12.012. PMID 21227550.
- ↑ 가 나 Chen, X; Tsiang, M; Yu, F; Hung, M; Jones, GS; Zeynalzadegan, A; Qi, X; Jin, H; Kim, CU; Swaminathan, S; Chen, JM (2008년 7월 11일). “Modeling, analysis, and validation of a novel HIV integrase structure provide insights into the binding modes of potent integrase inhibitors”. 《Journal of Molecular Biology》 380 (3): 504–19. doi:10.1016/j.jmb.2008.04.054. PMID 18565342.
- ↑ 가 나 Hombrouck, A.; Hantson, A.; van Remoortel, B.; Michiels, M.; Vercammen, J.; Rhodes, D.; Tetz, V.; Engelborghs, Y.; Christ, F.; Debyser, Z.; Witvrouw, M. (Jun 2007). “Selection of human immunodeficiency virus type 1 resistance against the pyranodipyrimidine V-165 points to a multimodal mechanism of action”. 《The Journal of Antimicrobial Chemotherapy》 59 (6): 1084–95. doi:10.1093/jac/dkm101. PMID 17470918.
- ↑ Wang, Z; Tang, J; Salomon, CE; Dreis, CD; Vince, R (2010년 6월 15일). “Pharmacophore and structure-activity relationships of integrase inhibition within a dual inhibitor scaffold of HIV reverse transcriptase and integrase”. 《Bioorganic & Medicinal Chemistry》 18 (12): 4202–11. doi:10.1016/j.bmc.2010.05.004. PMID 20576573.
