HIV-단백질분해효소 억제제의 발견과 발전
단백질 분해 효소의 활성을 조절하는 것은 많은 주요한 생리학적 과정들에 영향을 미치므로, 기질과 효소 간의 상호작용을 억제하면 극적인 결과를 이끌어낼 수 있다. 이러한 관점에서, 단백질 분해 효소 억제제와 같은 작은 리간드 분자는 효소의 촉매 활성을 조절할 수 있으므로 이러한 분자는 상당한 치료효과를 나타낼 수 있다.[1] 그러므로, HIV 단백질 분해효소를 억제하는 것은 HIV 감염을 막는 가장 중요한 치료법 중 하나이며,[2] 이 치료법의 개발은 구조 기반 약물 설계의 주요한 업적으로 여겨진다.[3] HIV 단백질 분해효소 억제제는 매우 효과적이며[4], 1990년대 이래로 HIV/AIDS의 중요한 치료법으로 사용되어 왔다.[5]
역사[편집]
HIV는 렌티바이러스이며, HIV-1과 HIV-2 라는 두가지 주요 종이 여기에 속한다. HIV-1은 대부분의 전염병을 유발하고, HIV-2는 서아프리카에 집중된 분포 양상을 보인다.[6] HIV 감염은 1981년 샌프란시스코와 뉴욕시에서 처음으로 보고되었다.[7] 1985년에 HIV가 AIDS의 원인 인자라는 것이 확인되었고, 곧바로 완전한 게놈이 밝혀졌다. 이러한 지식은 선택적 억제제를 개발하는데 기반이 되었다.[8]
HIV-2는 HIV-1보다 전파 위험이 조금 낮고, AIDS로 더 천천히 발전하는 경향이 있다.[7] 일반적으로 HIV는 HIV-1을 일컫는다.[9]
HIV-1 단백질 분해 효소는 가장 잘 알려진 아스파르트산 단백질 분해 효소 중 하나이며, AIDS 치료를 위한 좋은 표적이다.[10]
HIV 단백질 분해 효소의 발견이후로, 억제제가 시장에 출시되기까지 10년밖에 걸리지 않았다.[11] 1987년에 HIV 단백질 분해효소의 매우 선택적인 길항제가 처음으로 보고되었다. 사퀴나비르(saquinavir)는 1989년에 1상 임상 실험이 시작되었고, 1995년에 HIV 단백질 분해효소 억제제로서 최초로 처방약으로 승인받았다. 4달 후, 다른 단백질 분해효소 억제제인 리토나비르(ritonavir)와 인디나비르(indinavir)가 승인받았다.[6] 2009년에는 HIV 치료제로 10종의 단백질 분해효소가 출시되었으나, 암프레나비르(amprenavir)는 2004년에 시장에서 철수하였다.[6][12]
HIV의 생활사[편집]

HIV는 유전물질을 RNA의 형태로 운반하는 레트로바이러스이며, 표면 항원으로 CD4를 가지는 T세포를 감염시킨다. 바이러스와 표적 세포의 세포막이 융합되어야만, HIV는 그 세포를 감염시킬 수 있다.[13] 먼저, 바이러스의 외피 단백질인 gp120, gp41과 표적 세포의 CD4 수용체 사이에 상호작용이 있어야 한다. 그 후, 바이러스는 CXCR4 또는 CCR5와 같은 케모카인 공수용체(coreceptor)에 결합하고, 이는 바이러스 외피 단백질의 형태학적 변화를 일으킨다. 이러한 융합은 숙주 세포 안으로 바이러스의 캡시드가 들어갈 수 있는 구멍을 형성한다.[14] 세포 속으로 들어간 다음, 바이러스의 RNA는 바이러스 암호화 효소인 역전사 효소에 의해 DNA로 역전사된다. 역전사된 DNA는 핵으로 들어가서 바이러스 암호화 효소인 통합효소(integrase)에 의해 숙주 세포의 유전물질에 삽입된다. 숙주세포의 DNA가 전사될 때, 삽입된 바이러스 DNA는 함께 mRNA로 전사되고, 바이러스 단백질로 번역된 후, 바이러스 암호화 효소인 HIV 단백질 분해 효소에 의해 바이러스 전구체 단백질이 잘려서 성숙한 단백질 조각이 형성된다. 바이러스의 RNA와 단백질은 세포 표면에서 조립되어 새로운 비리온(virion)이 된다. 비리온은 세포로부터 빠져나와 다른 세포를 감염시킨다. 유전 물질이 파괴되고, 비리온이 밖으로 배출되면서 세포에 광범위한 손상이 가해지고, 결국에는 모든 감염된 세포는 죽게된다.[15]
단백질 분해효소 억제제의 작용 메커니즘[편집]
HIV 생활사를 방해하여 바이러스의 복제를 막을 수 있는 몇 가지 단계가 존재한다. 매우 중요한 단계는 HIV 단백질 분해효소에 의해 바이러스의 폴리펩타이드 전구체를 잘라서 성숙한 효소와 구조적 단백질로 바꾸는 단백질 분해 단계이다.[13] HIV 단백질 분해효소 억제제는 바이러스의 아스파르트산 단백질 분해효소의 작용을 경쟁적으로 저해하는 펩타이드 유사 물질이다. 이러한 약물은 바이러스의 중요한 구조적, 효소적 성분을 포함하는 HIV Gag- Pol 폴리펩타이드가 분해되는 것을 막음으로써, HIV 입자가 감염성이 있는 성숙한 형태로 변환되는 것을 억제한다.[6]
단백질 분해효소 억제제는 지방세포의 대사를 변화시켜 부작용으로 지방 이상증을 일으킨다. 이와 관련되어, 약물의 작용 메커니즘이 제안되었는데, 예를 들면 약물에 의해 지방세포의 분화와 중성지방의 축적이 억제되며, 지방분해가 증가된다는 것이다. 단백질 분해효소 억제제가 인슐린에 의해 조절되는 포도당 흡수에 미치는 영향과 관련되는 이론들도 지방 이상증과 연관되어 있다. 그 중 한 가지 이론은 단백질 분해효소 억제제가 인슐린 신호 전달의 초기 단계를 억제할 수 있다는 것이다. 인슐린에 의해 활성화되어, IRS-1의 타이로신 잔기가 인산화되는 것이 단백질 분해효소 억제제에 의해 감소될 수 있다. 또한, HIV 단백질 분해효소 억제제에 의해 아디포넥틴(adiponectin) 분비가 감소되고 인터루킨-6의 발현이 유도되며, 이로 인해 인슐린에 의해 활성화되는 포도당 흡수가 억제된다.[16]
단백질 분해효소 억제제의 설계[편집]
단백질 분해효소 억제제는 분해효소의 실제 기질의 전이 상태를 모방하여 설계되었다. 펩타이드 연결은 -NH-CO- 대신 -CH2-CH(OH)-으로 구성되는데, 이 결합은 단백질 분해효소에 의해 절단되지 못한다. HIV 단백질 분해효소는 HIV 아스파르트산 단백질 분해효소의 활성 자리에 잘 맞으며, 아스파르트산 단백질 분해효소의 작용 기전에 근거하여 설계되었다. 하이드록시에틸아민(hydroxyethylamine)은 가장 효과적으로 전이상태를 복제한 것으로, 사퀴나비르(saquinavir)라는 첫번째 단백질 분해효소 억제제를 발견하는데 기여했다. 그 이후로, 다른 HIV 단백질 분해효소 억제제는 같은 원리를 이용하여 설계되었다.[17]
결합자리[편집]

HIV 단백질 분해효소는 99개의 아미노산으로 이루어진 단량체 2개로 구성된 C2-대칭적, 동종이합체(homodimer)이다. 각각의 단량체는 촉매 작용에 중요한 아스파르트산 잔기인 Asp25, Asp25'를 가진다. HIV 단백질 분해효소는 Asp-Thr-Gly 서열을 가지는데, 이 서열은 다른 포유류의 아스파르트산 효소들에서 똑같이 나타난다. 플랩(flap)이라고 알려진 단량체의 확장된 베타 판 구조는 소수성 빈 공간의 아래에 있는 2개의 아스파르트산 잔기와 함께 기질 결합부위의 일부분을 구성하고 있다.[13][18][19] 각각의 유연한 플랩(flap)은 3개의 특징적인 부위를 포함하고 있다. 바깥쪽으로 돌출된 곁사슬인 Met46, Phe53, 안쪽으로 돌출된 소수성 곁사슬인 Ile47, Ile54, 글리신이 풍부한 부위인 Gly48, 49, 51, 52이 3개의 특징적인 부위이다. Ile50는 베타 턴(turn)의 끝에 위치하며, 효소에 리간드가 결합되어 있지 않을 때, 물분자가 각각의 단량체에 있는 Ile50의 뼈대에 수소결합을 형성한다.[19]
HIV 단백질 분해효소는 높은 서열 특이성과 촉매능으로 펩타이드 결합의 가수분해를 촉매한다. HIV 단백질 분해효소의 작용기전은 다른 아스파르트산 단백질 분해효소와 비슷하지만, 구체적인 기전에 대해서는 아직 완전히 알려져 있지 않다.[13] 물분자는 플랩(flap)을 열고 닫는데 중요한 역할을 할뿐만 아니라 효소와 기질 사이의 친화도를 높이는데도 중요하다. 아스파르트산 잔기는 펩타이드 결합의 가수분해에 관여한다.[19] 이 효소의 절단 부위는 아미노 말단의 프롤린 잔기이며, 특히 페닐알라닌과 프롤린 사이 또는 타이로신과 프롤린 사이다.[6][18]
발전[편집]
첫번째 HIV 단백질 분해효소 억제제인 사퀴나비르(saquinavir)는 작은 단백질 유사 사슬로, 하이드록시에틸아민[6]이며, 1995년 출시되었다.[20] 이 약물은 단백질 분해효소 기질의 전이상태 유사체이다.[6] HIV-1 단백질 분해효소가 디펩티드 Tyr-Pro 또는 Phe-Pro을 포함하는 서열을 절단하는 것이 약물 설계의 기반이 되었다.[21] 데카하이드로이소퀴놀린(DIQ)의 첨가는 사퀴나비르의 발견으로 이어지는 가장 중요한 변형 중 하나였다. 이 치환기는 억제제의 형태학적 자유도를 제한함으로써 물에 대한 용해도와 약효를 증가시켰다.[22] 사퀴나비르는 HIV-1과 HIV-2[23]모두에 효과가 있고, 내약성이 좋지만 혈청 내 높은 농도를 유지하는 데까지는 이르지 못하고 있다.[12]
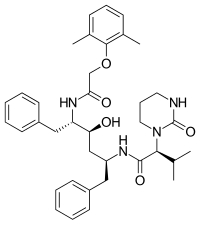
리토나비르(ritonavir)는 작은 단백질 유사 사슬로 되어 있는 HIV 단백질 분해효소 억제제이며, 1996년에 출시되었다.[20] 이 약물은 단백질 분해효소의 기질 결합자리에 있는 C2-대칭에 맞도록 설계되었다.[6] 리토나비르을 개발한 애보트 연구실은 바이러스에 대항하는 활성은 있지만 낮은 생체 이용률을 가지는 화합물로부터 시작했다. 말단에 있는 페닐기를 제거하고 그 대신 피리딘기를 붙여 물에 대한 용해도를 높이는 등 몇 가지 개선을 이루어냈고, 결국 최종 제품이 리토나비르였다.[21] 상당한 위장관 부작용과 알약 복용 부담이 리토나비르의 주요한 문제여서 단일 치료법으로 사용되지는 않는다.[12] 특히, 이 약물은 P450 사이토크롬 효소에 의한 신진대사의 강력한 억제제이므로, 오로지 약효를 증대시키기 위해 다른 단백질 분해효소 억제제와 병용하여 사용된다.[12]
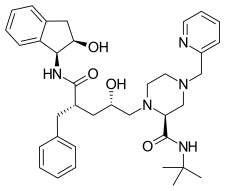
인디나비르(indinavir)는 작은 단백질 유사 사슬로 되어 있는 HIV 단백질 분해효소 억제제이며, 1996년에 출시되었다.[6][20] 억제된 효소 복합체의 X-ray 결정구조와 분자적 모델링에 의해 인디나비르가 설계될 수 있었다. 말단부의 페닐기 치환기는 소수성 상호작용에 기여했으며, 이는 약효를 증가시켰다.[21] 한편,인디나비르는 HIV Gag 폴리펩타이드의 페닐알라닌-프롤린 절단 부위 유사체이다.[6]
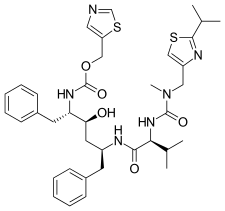
넬피나비어(nelfinavir)는 작은 단백질 유사 사슬로 되어 있지 않은 첫번째 단백질 분해효소였다. 경구 투여가 가능하고 펩타이드가 아닌 억제제인 넬피나비어를 설계하는 과정에서, 펩타이드 억제제의 반복적인 단백질 공결정구조 분석이 이용되었고, 억제제의 일부분은 펩타이드가 아닌 치환기로 대체되었다.[21] 넬피나비어는 새로운 2-메틸-3-하이드록시벤자마이드(2-methyl-3-hydroxybenzamide)를 포함하지만, 카복실 말단에는 사퀴나비르와 같은 DIQ 치환기를 가진다.[21] 한편, 넬피나비어는 1997년에 출시되었고[20], 소아 AIDS를 치료할 수 있는 첫번째 단백질 분해효소였다.[21]
암프레나비르(amprenavir)는 1999년 출시되었다.[20] 이 약물은 N,N-이중치환 아미노 술폰아마이드 비펩타이드계 HIV 단백질 분해 효소 억제제이며[6], 이전 단백질 분해효소 억제제와 몇 가지 공통점을 가진다. 사퀴나비르와 핵심적인 구조는 비슷하지만 아미노 말단과 카복시 말단의 작용기는 다르다. 한 말단에는 테트라하이드로퓨란 카바메이트기가 있고, 다른 말단에는 이소뷰틸페닐 술폰아마이드가 추가된 아마이드와 함께 있다. 이러한 구조로 인해 카이랄 중심이 적어지고, 그 결과 약물을 합성하기 더 쉬울뿐만 아니라 물에 대한 용해도를 높일 수 있어서 경구 생체이용률을 향상시킬 수 있다.[21] 그러나 암프레나비르의 전구 약물인 포삼프레나비어(fosamprenavir)가 여러 측면에서 우월성이 입증되어, 암프레나비르는 2004년 시장에서 철수하게 되었다.[6]
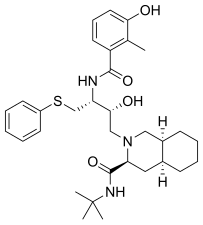
로피나비르(lopinavir)는 2000년 출시되었고,[20] 원래는 약물 저항성 바이러스의 HIV-1 단백질 분해효소에서 돌연변이가 생긴 Val82 잔기와 억제제간의 상호작용을 줄이기 위해 설계되었다.[21] 이 약물은 작은 단백질 유사 사슬로 되어 있는 HIV 단백질 분해효소 억제제이며[6], 핵심 구조는 리토나비르와 유사하다. 리토나비르의 말단에 있는 5-티아졸릴기(5-thiazolyl) 대신에, 로피나비르는 페녹시아세틸기(phenoxyacetyl)를 가지며, 리토나비르의 2-이소프로필티아졸릴기는 변형된 발린으로 대체되었는데, 아미노 말단에는 6각 고리 요소가 붙게 되었다.[21]
포삼프레나비어(fosamprenavir)는 2003년에 출시되었고[20], 암프레나비르로 신속히 다량으로 대사되는 인산에스터 전구약물이다.[24] 용해도와 생체이용률은 암프레나비르보다 좋아서[6], 약물 복용 부담이 줄어들었다.[25]
아타자나비어(atazanavir)는 2003년에 출시되었고[20], 아자펩티드 단백질 분해효소 억제제이며[20], 효소의 기질 결합 자리의 C2-대칭 부위에 맞도록 설계되었다.[12] 아타자나비어는 이전 HIV 단백질 분해효소 억제제보다 더 나은 약물 저항 수치를 나타냈다.[4] 산성 조건에서만 흡수될 수 있다는 점에서 특이하다.[12]
티프라나비르(tipranavir)는 펩타이드가 아닌 HIV-1 단백질 분해효소 억제제[12]이고, 2005년에 출시되었다.[20] 다른 HIV 단백질 분해효소 억제제와 달리, 티프라나비르는 비펩타이드성 쿠마린으로부터 개발되었으며, 단백질 분해효소 억제제로서의 기능은 고효율 스크리닝 기법을 통해 밝혀졌다.[26] 5,6-디하이드로-4-하이드록시-2-파이론(5,6-dihydro-4-hydroxy-2-pyrone)을 포함하는 술폰아마이드는 3-치환 쿠마린과 디하이드로파이론을 스크리닝하여 얻어졌다.[27] 티프라나비르는 다양한 단백질 분해효소 억제제에 저항성을 가지는 HIV-1에 대항하는 광범위한 항바이러스 작용을 한다.[28]
다루나비어(darunavir)는 2006년에 출시되었고[20], 말단에 있는 테트라퓨란(THF)에 변화를 준 암프레나비르의 비펩타이드성 유사체이다. 단일 THF 대신에, 다루나비어는 2개의 THF가 연결되어 이중-THF를 형성하여, 암프레나비르보다 약효가 뛰어나다. 이러한 구조적 변화와 함께, 이중-THF 주변의 입체화학적 특성으로 인한 배향 변화는 암프레나비르에 대해 저항성을 지니는 단백질 분해효소와 지속적인 결합이 가능하게 한다.[29]
FDA에 의해 승인 받은 모든 단백질 분해효소 억제제가 아래에 정리되어 있다.

|
|
|
|
| 사퀴나비르 | Nelfinavir | 리토나비르 | 로피나비르 |

|

|

|
|
| 암프레나비르 | 포삼프레나비르 | 다루나비르 | |
|

|
|
|
| 인디나비르 | Atazanavir | Tipranavir |
구조-활성 관계[편집]

쿠마린 화합물을 기반으로 핵심 구조를 형성한 티프라나비르(tipranavir)를 제외하고 나머지 모든 HIV 단백질 분해효소 억제제는 하이드록시에틸렌 화합물을 핵심 구조로 가진다.[17] HIV 단백질 분해효소 억제제에서 가장 중요한 작용기는 핵심 모티프에 있는 하이드록시기인데, 기질 결합 부위의 Asp25와 Asp25' 잔기에 있는 카복실산과 수소결합을 형성한다.[18][30] Ile50과 Ile50'에 연결된 물분자와 작은 단백질 유사 사슬로 된 억제제에 있는 카보닐기 사이의 수소 결합은 플랩(flap) 부위와 그것들을 이어준다.[21] 반면에, 비펩타이드성 억제제에는 양성자 수용체가 있어서 4개의 배위된 물분자를 대체하고 효소의 플랩(flap)에 있는 2개의 Ile50 잔기와 직접적으로 상호작용한다.[31] S1, S1',S2 and S2'로 불리는 HIV 단백질 분해 효소의 기질 결합 자리에 있는 특정한 포켓은 기질의 소수성 아미노산을 인식한다. 따라서, 이 부위를 보충해주는 소수성 작용기를 가지는 억제제의 약효는 증가한다.[32] 효소의 기질 결합 부위에 있는 몇몇 잔기들은 억제제의 친수성기와 수소 결합을 형성할 수 있다. 그 예로서, 암프레나비르(amprenavir)와 다루나비어(darunavir)의 THF 부위를 들 수 있다. 다루나비어는 암프레나비르와 달리, 단일 THF 대신 이중-THF를 가지므로, 더 많은 수소 결합을 형성할 수 있으며, 결합 에너지가 증가된다.[29]
저항성[편집]
형태학적 구조 변화를 일으키는 돌연변이는 HIV가 단백질 분해효소 억제제에 대해 저항성을 갖도록 한다.[29] 돌연변이 부위는 주로 HIV 단백질 분해효소의 활성자리에 위치하지만 활성자리 밖에도 존재한다. 이 돌연변이 부위에는 Gag-Pol 폴리펩타이드 전구체에 있는 단백질 분해 효소 절단부위가 포함된다. 절단 부위는 매우 다양한 서열을 가지므로, 단백질 분해효소는 기질을 인식할 때, 서열보다는 활성자리에 결합했을 때 나타나는 3차원 구조에 의존한다. 이 보존된 3차원 구조를 기질 외피(substrate envelope)라고 한다.[33] 활성 자리 변이는 억제제의 상호작용을 직접적으로 변화시키는데, 이는 주로 기질 외피 바깥의 단백질 분해효소 잔기와 억제제가 접촉하는 지점이다.[34] 활성자리가 아닌 부위에서 일어난 돌연변이는 이합체의 안정성과 형태학적 유연성에 영향을 미치는 것과 같이 다른 메커니즘으로 저항성을 획득한다.[35][36]
100개가 넘는 점돌연변이가 분석되었고, 그 중 적어도 26개는 단백질 분해 효소 억제제에 특이적이다. 이중 대략 15개는 약물 활성을 변화시키는, 중요한 돌연변이이다.[29] HIV-1 단백질 분해효소에서 돌연변이가 나타난 아미노산 잔기들이 많이 발견되었는데, 예를 들면 Leu33이 Ile, Val, Phe으로 변한 것, Val82이 Ala, Phe, Leu, or Thr으로 변한 것, Ile84가 Val으로 변한 것, Leu90이 Met으로 변한 것이 있다.[37] 서로 다른 돌연변이는 다른 단백질 분해효소 억제제에 영향을 미친다. 예를 들면, Leu90에서 일어난 변이는 사퀴나비르(saquinavir)와 넬피나비어(nelfinavir)에 영향을 미치지만, 인디나비르(indinavir)의 활성은 Met46, Val82, Ile84의 변이에 영향을 받고, 포삼프레나비어(fosamprenavir)는 Ile50이 Val으로 변할 때와 Ile84에 변이가 생길 때 활성이 달라진다. 많은 부위에 돌연변이가 생기면 높은 약물 저항성을 나타내지만, 단일 돌연변이는 단백질 분해효소 억제제에 대한 약물 저항성이 낮다.[29] 돌연변이는 1차 돌연변이와 2차 돌연변이로 나뉘는데, 1차 돌연변이는 저항성에 미치는 영향이 적다. 대부분의 단백질 분해 효소 억제제의 화학적 구조가 비슷하기 때문에, 몇몇 1차 돌연변이는 다수의 억제제에 대한 저항성을 야기할 수 있다. 교차 저항성은 단백질 분해효소 억제제로 치료할 때 발생하는 또 다른 주요한 문제이다.[38] 2차 돌연변이는 지속적으로 단백질 분해효소 억제제로 치료할 때, 발생하는 추가적인 돌연변이를 의미하며, 이것은 억제제에 대해 큰 저항성을 유발한다.[38]
스탠포드 HIV RT와 단백질 분해효소 서열 데이터베이스(HIV 약물 저항성 데이터베이스라고도 불린다.)는 항레트로바이러스 치료를 받은 사람에게서 HIV 역전사효소와 단백질 분해효소 서열을 기반으로 형성되었으며, 저항성-돌연변이, 유전자형-치료, 유전자형-표현형, 유전자형-결과 간의 상관관계를 알아볼 때, 공식적으로 이용된다.[39]
기질을 모방한 억제제가 기질 외피(substrate envelope)에 있으면서 활성자리 돌연변이에 의해 유발된 저항성을 회피할 수 있지만,[40][41] 활성자리로부터 멀리 떨어진 부위의 변이로 인해 발생한 약물 저항성 문제를 해결할 일반적인 약물 설계 방법은 존재하지 않는다. 한편, AIDS의 새로운 치료법을 개발하려는 연구는 이미 출시된 약물에 대해 교차 저항성을 피하는 것에 초점이 맞춰져 있다.[13]
최근 동향[편집]
2008년 1월, 다루나비어(darunavir)는 아직까지도 가장 최근에 출시된 HIV 단백질 분해효소 억제제였다.[42] 2006년, 글락소스미스클라인(GlaxoSmithKline)은 HIV 단백질 분해 효소 억제제로 개발 중이었던 브레카나비어(brecanavir)의 제 2상 임상시험을 중단했는데, 제형화와 관련된 문제 때문이었다.[43] 2009년 여름, 글락소스미스클라인과 Concert Pharmaceuticals는 중수소를 포함하는 약을 공동으로 개발하고 상품화하겠다고 발표했다. 그것들 중 하나가 HIV 단백질 분해효소 억제제인 CTP-518인데, 2009년 하반기에 제 1상 임상시험에 착수하기로 되어있었다. CTP-518은 아타자나비어(atazanavir)의 특정 수소 원자를 중수소로 대체함으로써 개발되었다. 전임상시험에서 이러한 변형으로 인해 항바이러스 약효가 증대되었으나, 간대사 작용을 늦출 수 있어 반감기와 약물 투여 후 혈청 최저 농도가 높아진다는 사실이 증명되었다. 따라서, CTP-518은 리토나비르(ritonavir)와 같이 약효를 증대시키는 다른 약물과 병용하여 사용할 필요가 없는 최초의 HIV 단백질 분해효소 억제제가 될 잠재성을 가지고 있다.[44]
각주[편집]
- ↑ Cuccioloni, M; Mozzicafreddo, M; Bonfili, L; Cecarini, V; Eleuteri, A. M.; Angeletti, M (2009). “Natural occurring polyphenols as template for drug design. Focus on serine proteases”. 《Chemical Biology & Drug Design》 74 (1): 1–15. doi:10.1111/j.1747-0285.2009.00836.x. PMID 19519739.
- ↑ Chen, X; Kempf, D. J.; Li, L; Sham, H. L.; Vasavanonda, S; Wideburg, N. E.; Saldivar, A; Marsh, K. C.; McDonald, E; Norbeck, D. W. (2003). “Synthesis and SAR studies of potent HIV protease inhibitors containing novel dimethylphenoxyl acetates as P2 ligands”. 《Bioorganic & Medicinal Chemistry Letters》 13 (21): 3657–60. doi:10.1016/j.bmcl.2003.08.043. PMID 14552751.
- ↑ Adachi, M; Ohhara, T; Kurihara, K; Tamada, T; Honjo, E; Okazaki, N; Arai, S; Shoyama, Y; Kimura, K; Matsumura, H; Sugiyama, S; Adachi, H; Takano, K; Mori, Y; Hidaka, K; Kimura, T; Hayashi, Y; Kiso, Y; Kuroki, R (2009). “Structure of HIV-1 protease in complex with potent inhibitor KNI-272 determined by high-resolution X-ray and neutron crystallography”. 《Proceedings of the National Academy of Sciences》 106 (12): 4641–6. Bibcode:2009PNAS..106.4641A. doi:10.1073/pnas.0809400106. PMC 2660780. PMID 19273847.
- ↑ 가 나 Yanchunas Jr, J; Langley, D. R.; Tao, L; Rose, R. E.; Friborg, J; Colonno, R. J.; Doyle, M. L. (2005). “Molecular basis for increased susceptibility of isolates with atazanavir resistance-conferring substitution I50L to other protease inhibitors”. 《Antimicrobial Agents and Chemotherapy》 49 (9): 3825–32. doi:10.1128/AAC.49.9.3825-3832.2005. PMC 1195399. PMID 16127059.
- ↑ Brower, E. T.; Bacha, U. M.; Kawasaki, Y; Freire, E (2008). “Inhibition of HIV-2 protease by HIV-1 protease inhibitors in clinical use”. 《Chemical Biology & Drug Design》 71 (4): 298–305. doi:10.1111/j.1747-0285.2008.00647.x. PMID 18312292. S2CID 8461472.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 Brunton, L.L.; Lazo, J.S.; Parker, K.L. (2006). 《Goodman and Gilmans's The Pharmacological Basis of Therapeutics》 11판. McGraw-Hill.
- ↑ 가 나 HIV Disease - eMedicine
- ↑ Brunton, L.L.; Lazo, J.S.; Parker, K.L. (2006). 《Goodman and Gilmans's The Pharmacological Basis of Therapeutics》 11판. McGraw-Hill.
- ↑ Kurup, Alka; Mekapati, Suresh; Garg, Rajni; Hansch, Corwin (2003). “HIV-1 Protease Inhibitors: A Comparative QSAR Analysis”. 《Current Medicinal Chemistry》 10 (17): 1679–88. doi:10.2174/0929867033457070. PMID 12871116.
- ↑ Shi, Haibin; Liu, Kai; Leong, Wendy W.Y.; Yao, Shao Q. (2009). “Expedient solid-phase synthesis of both symmetric and asymmetric diol libraries targeting aspartic proteases”. 《Bioorganic & Medicinal Chemistry Letters》 19 (14): 3945–8. doi:10.1016/j.bmcl.2009.03.041. PMID 19328682.
- ↑ Turk, Boris (2006). “Targeting proteases: successes, failures and future prospects”. 《Nature Reviews Drug Discovery》 5 (9): 785–99. doi:10.1038/nrd2092. PMID 16955069. S2CID 4156908.
- ↑ 가 나 다 라 마 바 사 Graziani, Amy L (2014년 6월 17일). “HIV protease inhibitors”. UpToDate.
- ↑ 가 나 다 라 마 Brik, A. and Wong, C.H. (2003) HIV-1 protease: mechanism and drug discovery. Organic & Biomolecular Chemistry. 1(1); 5–14.
- ↑ Warnke, D., Barreto, J. and Temesgen, Z. (2007) Antiretroviral drugs. Journal of Clinical Pharmacology. 47(12); 1570–1579.
- ↑ Brik, A. and Wong, C.H. (2003) HIV-1 protease: mechanism and drug discovery. Organic & Biomolecular Chemistry. 1(1); 5–14.
- ↑ Kim, R.J., Wilson, C.G., Wabitsch, M., Lazar, M.A. and Steppan, C.M. (2006) HIV protease inhibitor-specific alterations in human adipocyte differentiation and metabolism. Obesity. 14; 994–1002.
- ↑ 가 나 De Clercq, E. (2009) The history of antiretrovirals: key discoveries over the past 25 years. Reviews in Medical Virology. 19; 287–299.
- ↑ 가 나 다 Mimoto, T., Hattori, N., Takaku, H. et al. (2000) Structure-activity relationship of orally potent tripeptide-based HIV protease inhibitors containing hydroxymethylcarbonyl isostere. Chemical & Pharmaceutical Bulletin. 48(9); 1310–1326.
- ↑ 가 나 다 Perez, M.A.S., Fernandes, P.A. and Ramos, M.J. (2007) Drug design: New inhibitors for HIV-1 protease based on Nelfinavir as lead. Journal of Molecular Graphics and Modelling. 26; 634–642.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 Flexner, C. (2007) HIV drug development: the next 25 years. Nature Reviews Drug Discovery. 6; 959–966.
- ↑ 가 나 다 라 마 바 사 아 자 차 Wlodawer, A. (2002) Rational approach to AIDS drug design through structural biology. Annual Review of Medicine. 53; 595–614.
- ↑ Smith, H.J. and Simons, C. (2005) Enzymes and Their Inhibition: Drug Development (6th edition). United States of America: CRC press
- ↑ Brower, E. T.; Bacha, U. M.; Kawasaki, Y; Freire, E (2008). “Inhibition of HIV-2 protease by HIV-1 protease inhibitors in clinical use”. 《Chemical Biology & Drug Design》 71 (4): 298–305. doi:10.1111/j.1747-0285.2008.00647.x. PMID 18312292. S2CID 8461472.
- ↑ Chapman, T.M., Plosker, G.L. and Perry, C.M. (2004) Fosamprenavir – A Review of its Use in the Management of Antiretroviral Therapy-naive Patients with HIV Infection. Drugs. 64; 2101–2124.
- ↑ 가 나 다 라 마 McCoy, C. (2007) Darunavir: A nonpeptidic antiretroviral protease inhibitor. Clinical Therapeutics. 29(8); 1559–1576.
- ↑ Liu, F., Kovalevsky, A.Y., Tie, Y., Ghosh, A.K., Harrison, R.W. and Weber, I.T. (2008) Effect of Flap Mutations on Structure of HIV-protease and Inhibition by Saquinavir and Darunavir. Journal of Molecular Biology. 381(1); 102–115
- ↑ Lebon, F. and Ledecq, M. (2000) Approaches to the Design of Effective HIV-1 Protease Inhibitors. Current Medicinal Chemistry. 7; 455–477.
- ↑ Blum, A. et al. (2008) Achiral oligoamines as versatile tool for the development of aspartic protease inhibitors. Bioorganic & Medicinal Chemistry. 16; 8574–8586.
- ↑ Prabu-Jeyabalan, Nalivaika E, Schiffer CA. (2002) Substrate shape determines specificity of recognition for HIV-1 protease: analysis of crystal structures of six substrate complexes. "Structure" 10(3):369-81.
- ↑ King NM, Prabu-Jeyabalan M, Nalivaika EA, Schiffer CA (2004) Combating susceptibility to drug resistance: lessons from HIV-1 protease.Chem Biol. Oct;11(10):1333-8.
- ↑ Bihani, S. C., Das, A., Prashar, V., Ferrer, J.-L. and Hosur; M.V. (2009) Resistance mechanism revealed by crystal structures of unliganded nelfinavir-resistant HIV-1 protease non-active site mutants N88D and N88S. Biochemical and Biophysical Research Communications. 389; 295–300.
- ↑ de Vera IM, Smith AN, Dancel MC, Huang X, Dunn BM, Fanucci GE. (2013) Biochemistry. Elucidating a relationship between conformational sampling and drug resistance in HIV-1 protease. 14;52(19):3278-88. doi: 10.1021/bi400109d. Epub 2013 May 1.
- ↑ Lemke, T.L., Williams, D.A., Roche, V.F. and Zito, S.W. (2008) Foye´s Principles of Medicinal Chemistry ( 6th edition). United States of America: Lippincott williams & Wilkins, a Wolters Kluwer business.
- ↑ 가 나 Maarseveen, N.V. and Boucher, C. (2008) Antiretroviral Resistance in Clinical Practice. London: Mediscript Ltd.
- ↑ Robert W. Shafer. “Rationale and Uses of a Public HIV Drug-Resistance Database”. 《J Infect Dis》.
- ↑ Kairys V, Gilson MK, Lather V, Schiffer CA, Fernandes MX. (2009) Toward the design of mutation-resistant enzyme inhibitors: further evaluation of the substrate envelope hypothesis. Chem Biol Drug Des. Sep;74(3):234-45. doi: 10.1111/j.1747-0285.2009.00851.x
- ↑ Nalam MN, Ali A, Altman MD, Reddy GS, Chellappan S, Kairys V, Ozen A, Cao H, Gilson MK, Tidor B, Rana TM, Schiffer CA. (2010) Evaluating the substrate-envelope hypothesis: structural analysis of novel HIV-1 protease inhibitors designed to be robust against drug resistance. J Virol. 2010 May;84(10):5368-78. doi: 10.1128/JVI.02531-09. Epub 2010 Mar 17.
- ↑ De Clercq, E. (2009) Anti-HIV drugs: 25 compounds approved within 25 years after the discovery of HIV. International Journal of Antimicrobial Agents. 33; 307–320.
- ↑ “Archived copy”. 2008년 12월 3일에 원본 문서에서 보존된 문서. 2008년 6월 11일에 확인함. GlaxoSmithKline discontinues clinical development of investigational protease inhibitor brecanavir (640385). Retrieved November 4th. 2009.
- ↑ “Archived copy”. 2009년 8월 31일에 원본 문서에서 보존된 문서. 2009년 11월 5일에 확인함.GSK and Concert Pharmaceuticals form alliance to develop novel deuterium-modified drugs. Retrieved November 4th. 2009.
