잘시타빈
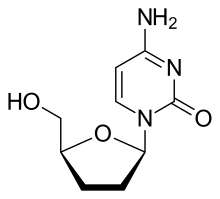
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
| 4-amino-1-((2R,5S)-5-(hydroxymethyl)tetrahydrofuran-2-yl)pyrimidin-2(1H)-one | |
| 식별 정보 | |
| CAS 등록번호 | 7481-89-2 |
| ATC 코드 | J05AF03 |
| PubChem | 24066 |
| 드러그뱅크 | DB00943 |
| ChemSpider | 22498 |
| 화학적 성질 | |
| 화학식 | C9H13N3O3 |
| 분자량 | ? |
| SMILES | eMolecules & PubChem |
| 약동학 정보 | |
| 생체적합성 | >80% |
| 단백질 결합 | <4% |
| 동등생물의약품 | ? |
| 약물 대사 | Hepatic |
| 생물학적 반감기 | 2 hours |
| 배출 | Renal (circa 80%) |
| 처방 주의사항 | |
| 임부투여안전성 | D(오스트레일리아)C(미국) |
| 법적 상태 | |
| 투여 방법 | Oral |
잘시타빈(2′-3′-dideoxycytidine, ddC)은 히비드(Hivid)라는 상품명으로 판매되는 뉴클레오시드 유사체 역전사효소 저해제(NRTI)이며, 디데옥시시티딘이라고도 불린다. 잘시타빈은 미국 식품의약국(FDA)으로부터 세번째로 허가받은, 후천면역결핍증후군을 치료하기 위한 항레트로바이러스제이다. 잘시타빈은 병용 요법으로 사용되는 약물 중 하나이다.
잘시타빈은 다른 뉴클레오시드 유사체 역전사효소 억제제보다 약의 효능이 더 약하며, 하루에 세번 복용해야한다는 불편한 점이 있고 심각한 이상반응을 동반한다는 특징을 가지고 있다. 이러한 특징들로 인해 인체면역결핍바이러스(HIV)를 치료하기 위해서 거의 사용되지 않으며 특정 나라에서는 제약 시장에서 완전히 배제되어 있기도 하다.[1]
역사[편집]
잘시타빈은 제롬 호르비츠(Jerome Horwitz)에 의 1960년대에 최초로 합성되었으며[2][3] 이후 미국의 국립 암 연구소(NCI)에서 사무엘 브로덜(Samuel Broder), 히로아키 미츠야(Hiroaki Mitsuya)와 로버트 얄초안(Robert Yarchoan)에 의해 점차적으로 항-HIV 약물로의 개발이 진행되었다. 디다노신처럼 이 약물 역시 NCI에서는 의약품을 판매하거나 시장을 형성할 수 없으므로 로슈 제약회사에 면허를 넘겨주었다.
잘시타빈은 후천 면역 결핍증을 치료하기 위한 목적으로 FDA로부터 허가받은 세번째 항레트로바이러스제이다. 이 의약품은 단독사용(단독제제)의 형태로 1992년 6월 9일에 승인을 받았으며, 그 후 지도부딘과 함께 사용하는 병용요법으로 1996년 다시 허가를 받았다. 후자의 방법(지도부딘과 잘시타빈을 병용하는 방법)보다 뉴클레오시드 유사체 역전사효소 저해제(NRTIs)에 포함되는 의약품 두 가지를 병용하는 방법이 더 선호되었으며, 두 가지의 NRTI와 단백질 분해 효소 억제제(PI)를 병용하는 3제 요법도 먼 미래의 일은 아니었다.
잘시타빈의 판매와 유통은 2006년 12월 31일을 기점으로 중단되었다.[4]
작용 메커니즘[편집]
잘시타빈은 피리미딘의 유사체이다. 이는 자연적으로 존재하는 디옥시시티딘의 유도체로서, 3번 위치에 있는 하이드록실기(hydroxyl)기가 수소로 대체된 형태이다.
잘시타빈은 T 세포와 HIV 타겟 세포 안에서 인산화되어 활성화 형태인 ddCTP로 변환된다. 이러한 활성 대사체는 HIV 역전사효소의 기질로 작용하기도 하며 바이러스 DNA에 끼어들어가 사슬 연장을 중단시킨다. 하이드록실기가 제거된 형태이기 때문에 사슬을 연장시키는 기존의 역할과 다르게 작동하는 것이다. 잘시타빈은 역전사효소 억제제이기 때문에 레트로바이러스에서만 효능을 보인다.
약동학적 특성[편집]
잘시타빈은 80%가 넘는, 굉장히 높은 비율의 경구 생체 이용률을 보인다. 잘시타빈은 신장을 통해서 주되게 제거(배설)되며, 2시간 정도의 반감기를 가진다.[4]
약물 상호작용[편집]
라미부딘(3TC)는 세포 내에서 일어나는 잘시타빈의 인산화 과정을 저해해서 잘시타빈의 활성화를 현저하게 억제하기 때문에, 이 약물은 잘시타빈과 같이 투여 혹은 병용해서는 안된다.[5]
또한, 잘시타빈은 디다노신 혹은 스타부딘과 같이 말초신경병증을 일으킬 수 있는 다른 의약품/약물들과 같이 사용해서는 안된다.[5]
부작용/이상반응[편집]
잘시타빈의 치료 초기에 가장 흔하게 나타나는 부작용은 구역과 두통이다. 더 심각한 이상반응으로는 중증으로 진행된 환자에게 33% 정도까지도 나타날 수 있는 말초신경병증, 구강(입) 궤양, 식도 궤양과 흔하지 않게는 췌장염이 있다.[5]
내성[편집]
잘시타빈에 대한 내성은 다른 뉴클레오시드 유사체 역전사효소 억제제(NRTIs)보다 드물게 나타나며, 주로 저용량 사용 시 관찰할 수 있다.[6] 생체 내에서 가장 흔하게 관찰되는 돌연변이는 T69D로, 다른 뉴클레오시드 유사체 역전사효소 억제제(NRTIs)와 교차내성을 나타내지 않는다. pol 유전자의 65, 74, 75, 184와 215 위치에서의 돌연변이는 더욱 드물게 관찰된다.[5][6]
특수 의약품[편집]
디데옥시시티딘은 1992년에 특수의약품으로 선정되었다.[7]
각주[편집]
- ↑ “zalcitabine (CHEBI:10101)”. 《www.ebi.ac.uk》. 2021년 1월 18일에 확인함.
- ↑ Horwitz JR, Chua J, Da Rooge MA, Noel M, Klundt IL (January 1966). “Nucleosides. IX. The formation of 2',2'-unsaturated pyrimidine nucleosides via a novel beta-elimination reaction”. 《The Journal of Organic Chemistry》 (American Chemical Society (ACS)) 31 (1): 205–11. doi:10.1021/jo01339a045. PMID 5900814.
- ↑ Oral account of the history of AZT, d4T and ddC by Jerome Horwitz and Hiroaki Mitsuya in the documentary film I am alive today - History of an AIDS drug Archived 2016년 3월 3일 - 웨이백 머신.
- ↑ 가 나 “HIVID (zalcitabine) tablets.” (PDF). 《M.D./alert》. U.S. Food and Drug Administration. June 2006. 2012년 2월 3일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ 가 나 다 라 “HIVID (zalcitabine) tablets. Product information.” (PDF). Roche. September 2002. 2009년 9월 16일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ 가 나 Moyle GJ (August 1996). “Use of viral resistance patterns to antiretroviral drugs in optimising selection of drug combinations and sequences”. 《Drugs》 (Springer Nature) 52 (2): 168–85. doi:10.2165/00003495-199652020-00002. PMID 8841736. S2CID 27709969.
- ↑ Töglhofer W (1992). “[New, in Austria registered specialty drugs. Hivid (2',3'-dideoxycytidine; ddC)]”. 《Wiener Klinische Wochenschrift》 104 (12): 363–7. PMID 1353278.
추가 자료[편집]
- Yarchoan R, Mitsuya H, Broder S (October 1988). “AIDS therapies”. 《Scientific American》 (Springer Nature) 259 (4): 110–9. Bibcode:1988SciAm.259d.110Y. doi:10.1038/scientificamerican1088-110. PMID 3072667.
- Remington, Joseph Price (1990). Gennard, Alfonso R., 편집. 《Remington's Pharmaceutical Sciences》 18판. Easton, PA: Mack Publishing Company. ISBN 978-0-912734-04-0. OCLC 24381485.
- Rang HP, Dale MM, Ritter JM (1995). 《Pharmacology》 3판. United Kingdom: Elsevier Churchill Livingstone. ISBN 978-0-443-07560-5. OCLC 903083639.
- Mitsuya H, Broder S (March 1986). “Inhibition of the in vitro infectivity and cytopathic effect of human T-lymphotrophic virus type III/lymphadenopathy-associated virus (HTLV-III/LAV) by 2',3'-dideoxynucleosides”. 《Proceedings of the National Academy of Sciences of the United States of America》 83 (6): 1911–5. Bibcode:1986PNAS...83.1911M. doi:10.1073/pnas.83.6.1911. PMC 323194. PMID 3006077.
- Yarchoan R, Perno CF, Thomas RV, Klecker RW, Allain JP, Wills RJ, 외. (January 1988). “Phase I studies of 2',3'-dideoxycytidine in severe human immunodeficiency virus infection as a single agent and alternating with zidovudine (AZT)”. 《Lancet》 (Elsevier BV) 1 (8577): 76–81. doi:10.1016/s0140-6736(88)90283-8. PMID 2891981. S2CID 35816286.
- Mitsuya H, Yarchoan R, Broder S (September 1990). “Molecular targets for AIDS therapy”. 《Science》 (American Association for the Advancement of Science (AAAS)) 249 (4976): 1533–44. Bibcode:1990Sci...249.1533M. doi:10.1126/science.1699273. PMID 1699273.
- Moyle G (March 1998). “A re-evaluation of zalcitabine”. 《Expert Opinion on Investigational Drugs》 (Informa Healthcare) 7 (3): 451–62. doi:10.1517/13543784.7.3.451. PMID 15991985.
- “In Their Own Words: Samuel Broder, M.D.”. 《Office of History, National Institutes of Health》. 1997년 2월 2일. 2018년 10월 18일에 확인함.
- “In Their Own Words: Robert Yarchoan, M.D.”. 《Office of History, National Institutes of Health》. 1998년 4월 3일. 2018년 10월 18일에 확인함.
